干热灭菌法验证与湿热灭菌法相同,应进行热分布试验、热穿透试验、生物指示剂验证试验或细菌内毒素灭活验证试验。以确认灭菌柜中的温度分布符合设定的标准、确定**冷点位置、确认**冷点标准灭菌时间(FH)能达到设定标准并达到SAL要求。常用的生物指示剂为枯草芽孢杆菌孢子(Spores of Bacillus subtilis)。细菌内毒素灭活验证试验是证明除热原过程有效性的试验。一般将不小于1000单位的细菌内毒素加入待去热原的物品中,证明该去热原工艺能使内毒素**少下降3个对数单位。细菌内毒素灭活验证试验所用的细菌内毒素一般为大肠杆菌内毒素(Escherichia coli endoxin)。验证时,一般采用**大装载方式。 #p#分页标题#e#
本法系指将灭菌产品置于适宜放射源辐射的γ射线或适宜的电子加速器发生的电子束中进行电离辐射而达到杀灭微生物的方法。本法**常用的为60Co-γ射线辐射灭菌。医疗器械、容器、生产辅助用品、不受辐射破坏的原料药及成品等均可用本法灭菌。
采用辐射灭菌法灭菌的无菌产品其SAL应≤10-6。γ射线辐射灭菌所控的参数主要是辐射剂量(指灭菌物品的吸收剂量)。该剂量的制定应考虑灭菌物品的适应性及可能污染的微生物**大数量及**强抗辐射力,所使用的剂量事先应验证其有效性及安全性。常用的辐射灭菌吸收剂量为25kGy。对**终产品、原料药、某些医疗器材应尽可能采用低辐射剂量灭菌。灭菌前,应对被灭菌物品微生物污染的数量和抗辐射强度进行测定,以评价灭菌过程赋予该灭菌物品的无菌保证水平。 灭菌时,应采用适当的化学或物理方法对灭菌物品吸收的辐射剂量进行监控,以充分证实灭菌物品吸收的剂量是在规定的限度内。如采用与灭菌物品一起被辐射的放射性剂量计,剂量计要置于规定的部位。在初安装时剂量计应用标准源进行校正,并定期进行再校正。
本法系指用化学消毒剂形成的气体杀灭微生物的方法。在充有灭菌气体的高压腔室内进行。常用的化学消毒剂有环氧乙烷、气态过氧化氢、甲醛、臭氧(O3)等,本法适用于在气体中稳定的物品灭菌。采用气体灭菌法时,应注意灭菌气体的可燃可爆性、致畸性和残留毒性。 本法中**常用的气体是环氧乙烷,一般与80%~90%的惰性气体混合使用。该法可用于医疗器械,塑料制品等不能采用高温灭菌的物品灭菌。含氯的物品及能吸附环氧乙烷的物品则不宜使用。另外,使用气态过氧化氢和臭氧(O3)灭菌,因其无危害性残留物,不会对操作人员和环境造成危害,适合于空间和物品表面的灭菌。
采用环氧乙烷灭菌时,灭菌柜内的温度、湿度、灭菌气体浓度、灭菌时间是影响灭菌效果的重要因数。可采用下列灭菌条件: 温度 ( 54 ±10)℃ 相对湿度 (60±10)% 灭菌压力 8×105Pa 灭菌时间 90min
灭菌条件应予验证。灭菌时,先将灭菌腔室先抽成真空,然后通入蒸汽使腔室内达到设定的
温湿度平衡的额定值,再通入经过滤和预热的环氧乙烷气体。灭菌过程中,应严密监控腔室的温度、湿度、压力、环氧乙烷浓度及灭菌时间。必要时使用生物指示剂监控灭菌效果。本法灭菌程序的控制具有一定难度,整个灭菌过程应在技术熟练人员的监督下进行。灭菌后,应采取新鲜空气置换,使残留环氧乙烷和其他易挥发性残渣消散。并对环氧乙烷残留物和反应产物进行监控,以证明其不超过规定浓度,避免产生毒性。
环氧乙烷灭菌法验证时,应进行如下试验:泄漏试验,以确认灭菌腔室的密闭性;生物指示剂的验证试验,指示剂一般采用枯草芽孢杆菌孢子(Spores of Bacillus subtilis);灭菌后换气次数的验证试验,确认环氧乙烷及相应的反应产物含量在限定的范围内。验证设计时,还应考虑物品包装材料和灭菌腔室中物品的排列方式对灭菌气体的扩散和渗透的影响。 五、过滤除菌法
本法系利用细菌不能通过致密具孔滤材的原理以除去气体或液体中微生物的方法。常用于热不稳定的药品溶液或原料的除菌。除菌过滤器采用孔径分布均匀的微孔滤膜作过滤材料,微孔滤膜分亲水性和疏水性两种。滤膜材质依过滤物品的性质及过滤目的而定。药品生产中采用的除菌滤膜孔径一般不超过0.22μm。过滤器不得对被滤过成分有吸附作用,也不能释放物质,不得有纤维脱落,禁用含石棉的过滤器。滤器和滤膜在使用前应进行洁净处理,并用高压蒸汽进行灭菌或作在线灭菌。更换品种和批次应先清洗滤器,再更换滤膜。 过滤过程中无菌保证与过滤液体的初始生物负荷及过滤器的对数下降值LRV(Log Reduction Value)有关。LRV系指规定条件下,被过滤液体过滤前的微生物数量与过滤后的微生物数量比的常用对数值。 即: LRV=lgN0- LgN 式中N0为产品除菌前的微生物数量。 N 为产品除菌后的微生物数量。
LRV用于表示过滤器的过滤除菌效率,对孔径为0.22μm的过滤器而言,要求每1cm2有效过滤面积的LRV应不小于7。因此过滤除菌时,被过滤产品总的污染量应控制在规定的限度内。为保证过滤除菌效果,可使用两个过滤器串连过滤,或在灌装前用过滤器进行再次过滤。 在过滤除菌中,一般无法对全过程中过滤器的关键参数(滤膜孔径的大小及分布,滤膜的完整性及LRV)进行监控。因此,在每一次过滤除菌前后均应作滤器的完整性试验,即气泡点试验或压力维持试验或#p#分页标题#e#气体扩散流量试验。确认滤膜在除菌过滤过程中的有效性和完整性。除菌过滤器的使用时间不应超过一个工作日,否则应进行验证。 过滤系统的验证包括过滤系统对过滤液体的适应性、过滤材料对溶液的污染程度、过滤器的规格、过滤器的灭菌方法、过滤系统的完整性试验、生物指示剂试验、过滤液体的微生物含量控制及过滤时间、过滤器的使用寿命等。上述试验大部分可由滤器的生产厂商来进行。微生物挑战性试验常用的生物指示剂为缺陷假单胞菌(Pseudomonas diminuta)。
通过过滤除菌法达到无菌的产品应严密监控其生产环境的洁净度,建议在无菌环境下进行过滤操作。相关的设备、包装容器、塞子及其它物品应采用适当的方法进行灭菌,并防止再污染。 六、无菌生产工艺
无菌生产工艺系指必须在无菌控制条件下生产无菌制剂的方法,无菌分装及无菌冻干是**常见的无菌生产工艺。后者在工艺过程中须采用过滤除菌法。
无菌生产工艺应严密监控其生产环境的洁净度,并应在无菌控制的环境下进行过滤操作。相关的设备、包装容器、塞子及其它物品应采用适当的方法进行灭菌,并防止被再次污染。无菌生产工艺过程的无菌保证应通过培养基无菌灌装摸拟试验验证,试验结果的阳性率不得超过0.1%(置信度取95%)。在生产过程中,应严密监控生产环境的无菌空气质量、操作人员的素质、各物品的无菌性。
无菌生产工艺应定期进行验证,包括对环境空气过滤系统有效性验证及培养基模拟灌装试验。
生物指示剂
生物指示剂系一类特殊的活微生物制品。可用于确认灭菌设备的性能、灭菌程序的验证、生产过程灭菌效果的监控等。用于灭菌验证中的生物指示剂一般是细菌的孢子。 1.制备生物指示剂用微生物的基本要求
不同的灭菌方法使用不同的生物指示剂,制备生物指示剂所选用的微生物必须具备以下特性:
(1) (1) 菌种的耐受性应大于需灭菌产品中所有可能污染微生物的耐受性。
(2) (2) 菌种应无致病性。
(3) (3) 菌株应稳定。存活期长,易于保存。
(4) 易于培养。若使用休眠孢子,生物指示剂中休眠孢子含量要在90%以上。
1. 1. 生物指示剂的制备
生物指示剂的制备应按一定的程序进行,制备前,需先确定所用微生物的特性,
如D值(微生物的耐热参数,系指一定温度下,将微生物杀灭90%所需的时间,以分表示)值等。菌株应用适宜的培养基(如产孢子的培养基)进行培养。培养物应制成悬浮液,其中孢子的数量应占优势,孢子应悬浮于无营养的液体中保存。
生物指示剂中包含一定数量的一种或多种孢子,可制成多种形式,通常是将一定数量的孢子附着在无生命的载体上,如滤纸条、玻片、不锈钢、塑料制品等;孢子悬浮液也可密封于安瓿中;有的生物指示剂还配有培养基系统。生物指示剂应选用合适的材料包装,并设定 有效期。载体和包装材料在保护生物指示剂不被污染和损耗的同时,还应保证灭菌剂穿透并能与生物指示剂充分接触。载体和包装应设计原则是便于贮存、运输、取样、转移接种。
有些生物指示剂可直接将孢子接种**液体灭菌物或具有与其相似的物理和化学特性的替代品中。使用替代品时,应用数据证明二者的等效性。1. 2. 生物指示剂的应用
在灭菌程序的验证中,尽管可通过灭菌过程某些参数的监控来评估灭菌效果,但生物指示剂的被杀灭程度,则是评价一个灭菌程序有效性**直观的指标。可使用市售的标准生物指示剂,也可使用由日常生产污染菌监控中分离的**耐受微生物制备的孢子。在生物指示剂验证试验中,需确定孢子在实际灭菌条件下的耐受性,并测定孢子的纯度和数量。验证时,生物指示剂的微生物用量应比日常检出的微生物污染量大,耐受性强,以保证灭菌程序有更大的安全性。在**终灭菌法中,生物指示剂应放在灭菌柜的不同部位。并避免指示剂直接接触到被灭菌物品。生物指示剂按设定的条件灭菌后取出,分别置培养基中培养,确定生物指示剂中的孢子是否被完全杀灭。
过度杀灭产品灭菌验证一般不考虑微生物污染水平,可采用市售的生物指示剂。对灭菌手段耐受性差的产品,设计灭菌程序时,根据经验预计在该生产工艺中产品微生物污染的水平,选择生物指示剂的菌种和孢子数量。这类产品的无菌保证应通过监控每批灭菌前的微生物污染的数量、耐受性和灭菌程序验证所获得的数据进行评估 4.常用生物指示剂
(1)湿热灭菌法:湿热灭菌法**常用的生物指示剂为嗜热脂肪芽孢杆菌孢子(Spores of Bacillus stearothermophilus,如NCTC 10 007、NCIMB 8157、ATCC 7953)。D值为1.5~3.0min,每片(或每瓶)活孢子数5×105~5×106个,在121℃、19min下应被完全杀灭。此外,还可使用生孢梭菌孢子(Spores of Clostridium sporogenes如NCTC 8594、NCIMB 8053、ATCC 7955),D值为0.4~0.8min。 #p#分页标题#e#
(2)干热灭菌法:干热灭菌法**常用的生物指示剂为枯草芽孢杆菌孢子(Spores of Bacillus subtilis,如NCIMB 8058、ATCC 9372)。D值大于1.5min,每片活孢子数5×105~5×106个。去热原验证时使用大肠杆菌内毒素(Escherichia coli endoxin),加量不小于1000细菌内毒素单位。
(3) 辐射灭菌法:辐射灭菌法**常用的生物指示剂为短小芽孢杆菌孢子(Spores of Bacillus pumilus,如NCTC 10 327、NCIMB 10 692、ATCC 27 142)。每片活孢子数107~108,置于放射剂量25kGy条件下,D值约3kGy。但应注意灭菌产品中所负载的微生物可能比短小芽孢杆菌孢子显示更强的抗辐射力。因此短小芽孢杆菌孢子可用于监控灭菌过程,但不能用于灭菌辐射剂量的建立。
(4) 气体灭菌法:环氧乙烷灭菌**常用的生物指示剂为枯草芽孢杆菌孢子(Spores of Bacillus
subtilis,如NCTC 10 073、ATCC 9372)。气态过氧化氢灭菌**常用的生物指示剂为嗜热脂肪芽孢杆菌孢子(Spores of Bacillus stearothermophilus,如NCTC 10 007、NCIMB 8157、ATCC 7953)。每片活孢子数1×106~5×106个。环氧乙烷灭菌中,枯草芽孢杆菌孢子D值大于2.5min,在环氧乙烷浓度为600mg/L,相对湿度为60%,温度为54℃下灭菌,60min应被杀灭。
⑸ 过滤除菌法:过滤除菌法**常用的生物指示剂为缺陷假单胞菌(Pseudomonas diminuta,如
ATCC19 146),用于滤膜孔径为0.22μm的滤器;黏质沙雷菌(Serratin marcescens)(ATCC 14 756),用于滤膜孔径为0.45μm的滤器 。 有效期。载体和包装材料在保护生物指示剂不被污染和损耗的同时,还应保证灭菌剂穿透并能与生物指示剂充分接触。载体和包装应设计原则是便于贮存、运输、取样、转移接种。
有些生物指示剂可直接将孢子接种**液体灭菌物或具有与其相似的物理和化学特性的替代品中。使用替代品时,应用数据证明二者的等效性。
1. 2. 生物指示剂的应用
在灭菌程序的验证中,尽管可通过灭菌过程某些参数的监控来评估灭菌效果,但生物指示剂的被杀灭程度,则是评价一个灭菌程序有效性**直观的指标。可使用市售的标准生物指示剂,也可使用由日常生产污染菌监控中分离的**耐受微生物制备的孢子。在生物指示剂验证试验中,需确定孢子在实际灭菌条件下的耐受性,并测定孢子的纯度和数量。验证时,生物指示剂的微生物用量应比日常检出的微生物污染量大,耐受性强,以保证灭菌程序有更大的安全性。在**终灭菌法中,生物指示剂应放在灭菌柜的不同部位。并避免指示剂直接接触到被灭菌物品。生物指示剂按设定的条件灭菌后取出,分别置培养基中培养,确定生物指示剂中的孢子是否被完全杀灭。
过度杀灭产品灭菌验证一般不考虑微生物污染水平,可采用市售的生物指示剂。对灭菌手段耐受性差的产品,设计灭菌程序时,根据经验预计在该生产工艺中产品微生物污染的水平,选择生物指示剂的菌种和孢子数量。这类产品的无菌保证应通过监控每批灭菌前的微生物污染的数量、耐受性和灭菌程序验证所获得的数据进行评估。 4.常用生物指示剂
(1)湿热灭菌法:湿热灭菌法**常用的生物指示剂为嗜热脂肪芽孢杆菌孢子(Spores of Bacillus stearothermophilus,如NCTC 10 007、NCIMB 8157、ATCC 7953)。D值为1.5~3.0min,每片(或每瓶)活孢子数5×105~5×106个,在121℃、19min下应被完全杀灭。此外,还可使用生孢梭菌孢子(Spores of Clostridium sporogenes如NCTC 8594、NCIMB 8053、ATCC 7955),D值为0.4~0.8min。
(2)干热灭菌法:干热灭菌法**常用的生物指示剂为枯草芽孢杆菌孢子(Spores of Bacillus subtilis,如NCIMB 8058、ATCC 9372)。D值大于1.5min,每片活孢子数5×105~5×106个。去热原验证时使用大肠杆菌内毒素(Escherichia coli endoxin),加量不小于1000细菌内毒素单位。
(3) 辐射灭菌法:辐射灭菌法**常用的生物指示剂为短小芽孢杆菌孢子(Spores of Bacillus pumilus,如NCTC 10 327、NCIMB 10 692、ATCC 27 142)。每片活孢子数107~108,置于放射剂量25kGy条件下,D值约3kGy。但应注意灭菌产品中所负载的微生物可能比短小芽孢杆菌孢子显示更强的抗辐射力。因此短小芽孢杆菌孢子可用于监控灭菌过程,但不能用于灭菌辐射剂量的建立。
(4) 气体灭菌法:环氧乙烷灭菌**常用的生物指示剂为枯草芽孢杆菌孢子(Spores of Bacillus
subtilis,如NCTC 10 073、ATCC 9372)。气态过氧化氢灭菌**常用的生物指示剂为嗜热脂肪芽孢杆菌孢子(Spores of Bacillus stearothermophilus,如NCTC 10 007、NCIMB 8157、ATCC 7953)。每片活孢子数1×106~5×106个。环氧乙烷灭菌中,枯草芽孢杆菌孢子D值大于2.5min,在环氧乙烷浓度为600mg/L,相对湿度为60%,温度为54℃下灭菌,60min应被杀灭。⑸ 过滤除菌法:过滤除菌法**常用的生物指示剂为缺陷假单胞菌(Pseudomonas diminuta,如
ATCC19 146),用于滤膜孔径为0.22μm的滤器;黏质沙雷菌(Serratin marcescens)(ATCC 14 756),用于滤膜孔径为0.45μm的滤器 。 </FONT< p>#p#分页标题#e#
常用灭菌法 一、物理灭菌法:
(一)热力灭菌法:1、干热灭菌法: 是利用火焰或干热空气进行灭菌,大多用于用具及器皿等。 2、湿热灭菌法:(1)热压灭菌法:用饱和水蒸汽排尽空气后,在一定温度和压力下进行灭菌。水蒸汽压力与温度对应如下:
20.594(kpa)-105.7℃,34.3233-108.8℃,41.1879-110.3℃,68.6466-115.5℃,75.1121-116.8℃,96.1052-120.2℃……
(2)流通蒸汽灭菌法和煮沸灭菌法:100℃,适用于不耐高温的药剂。
(3)低温间歇灭菌法:80℃加热1小时,20~25℃下放置24小时,连续操作三次以上,适用于不耐热药剂,灭菌效果差,须加防腐剂。
(二)过滤灭菌法:1、垂熔玻璃滤器:G际标准为P250~P2,滤过粒子由大到小。P2可滤除大肠杆菌及葡萄球菌。
2、微孔滤膜:我G为醋酸纤维素酯滤膜,或硝酸纤维素酯与醋酸纤维素酯的混合纤维素酯滤膜。特性:耐120℃30分钟灭菌;无脱屑;不耐碱;不耐有机溶剂;易燃。孔径 5.0mm用于注射液初滤,0.8mm用于精滤,0.45mm可滤去大多数细菌,0.15mm可滤去热原。
(三)紫外线灭菌法:波长200~300nm,易穿透洁净的水和空气,用于空气和物体表面灭菌。紫外线灯有效使用期一般为3000小时。 紫外线照射时间对微生物杀灭率见表: 照射时间(小时) 杀 灭 率 (%)
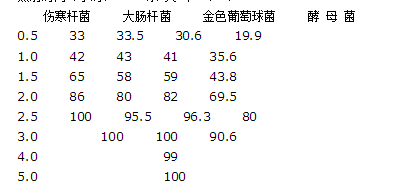
(四)微波灭菌法:为300~3000兆赫的电磁波。水可强烈吸收微波,使极性分子转动摩擦而产热。能穿透物质较深部,灭菌效果好。有望用于注射液的灭菌。
(五)辐射灭菌法:又称电离辐射,是用g-射线或b-射线照射杀菌。前者由钴-60或铯-137发出,穿透力强;后者由电子加速器产生,带电荷,穿透力弱,灭菌效果差。对于辐射,无芽胞菌比有芽胞菌敏感得多;无芽胞菌中革兰氏阴性菌比阳性菌敏感;而病毒敏感性很差。此外,辐射能引起一些药物pH值、含量、活性等改变,某些制品不宜选用。
二、化学灭菌法:一般以喷洒(雾)、蒸发等方法进行灭菌。
(一)环氧乙烷:无色醚样臭味气体,沸点10.8℃,沸点以下为无色透明液体,比重0.882,溶于水。扩散穿透能力强,属广谱杀菌剂。用于对热敏感的药物、塑料、橡胶、皮革制品、皮料、纸张以及小型玻璃器皿等的灭菌。
(二)过氧乙酸:无色透明液体,有刺激性醋酸臭和味,易挥发,有腐蚀性。易溶于水、乙醇、乙醚、醋酸。可缓慢分解,急剧分解时会爆炸。但40%以下的溶液则不会。本品广谱、高效、速效,毒性低,0.5%溶液用于空气(喷雾30ml/m3)、器械和皮肤消毒,临用前配制。
(三)其它:1、苯酚(石炭酸):3~5%地面、墙壁喷撒。 2、甲酚皂溶液(来苏尔):5~100%地面、墙壁喷撒。
3、甲醛溶液(福尔马林):20ml/m3加热蒸发,6~12小时。 4、乳酸:1ml/m3加热蒸发0.5~1小时。 5、苯扎溴铵:1/1000~1/2000溶液喷撒地面、墙壁。 6、丙二醇:1ml/m3加热蒸发
